Jurnal Praktikum Kimia Organik II Percobaan VI : Skrinning Fitokimia Senyawa Bahan Alam
I. Judul : Skrinning Fitokimia Senyawa Bahan Alam
II. Hari/Tanggal : Rabu, 16 Oktober 2019
III. Tujuan : Adapun tujuan dari percobaan ini adalah
1. Dapat mengenal dan memahami teknik-teknik skrinning fitokimia bahan alam
2. Dapat mengetahui jenis-jenis pereaksi yang digunakan dalam skrinning fitokimia bahan kimia.
3. Dapat melakukan skrinning fitokimia bahan alam dari suatu simplisia tumbuhan.
IV. Landasan Teori
Tumbuhan memiliki kemampuan untuk menghasilkan suatu senyawa yang istimewa memalui kemampuannya dalam metabolism. Senyawa-senyawa yang dapat dihasilkan oleh tumbuhan dikelompokkan menjadi dua kelompok, yaitu:
1. Senyawa dari metabolism primer
Senyawa yang termasuk kelompok ini adalah senyawa-senyawa organic yang dapat digunakan untuk metabolism tumbuhan tersebut. Contohnya karbohidrat, lipid, protein, dan asam amino.
2. Senyawa dari metabolism sekunder
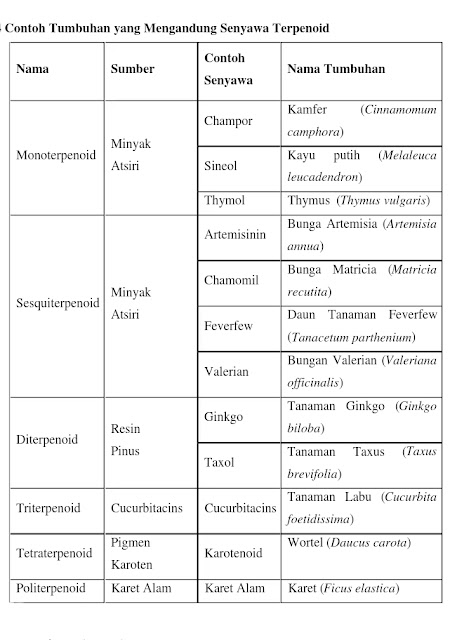
Senyawa yang termasuk kelompok senyawa ini adalah senyawa organic hasil sampingan dari metabolism. Senyawa-senyawa golongan ini biasanya memiliki banyhak manfaat untuk pengobatan. Contohnya seperti alkaloid, steroid, flavonoid, terpenoid, fenolik, kumarin, kuinon, tinnin, lignin, dan glikosida.
Senyawa-senyawa organic yang dihasilkan melalui metabolism sekunder ini sering disebut kimia bahan alam
(Tim Kimia Organik, 2019)
Senyawa-senyawa bahan alam hasil metabolism sekunder memiliki banyak sekali manfaat apabila dikonsumsi oleh makhluk hidup. banyak. Oleh sebab itu, banyak para ilmuwan terutama di bidang farmasi, mempelajari bagaimana mengisolasi senyawa bahan alam ini. Sebnyawa-senyawa ini dapat diidentifikasi dengan beberapa pereaksi, dimana senyawa-senyawa ini akan menghasilkan ciri-ciri tertentu apabila direaksikan dengan pereaksi tertentu pula (Kristianti, 2006).
Farnsworth (1996) menyatakan bahwa skrinning fitokimia merupakan proses pemeriksaan kandungan senyawa-senyawa aktif yang terdapat pada tumbuhan. Pemeriksaan senyawa –senyawa ini dilakukan dengan menanbahkan pereaksi-pereaksi yang sesuai.
Metode skrinning fitokimia ini merupakan suatu proses pemeriksaan kandungan senyawa-senyawa aktif yang terdapat pada tumbuhan. Pemeriksaan senyawa –senyawa ini dilakukan dengan menanbahkan pereaksi-pereaksi yang sesuai. Pad pereaksian ini akan menghasilkan perubahan warna. Dengan perubahan warna inilah kita dapat mengetahui ada tidaknya kandungan senyawa bahan alam (Fessenden, 1981).
Pemilihan metode skkrinning dilakukan harus memenuhi syarat berikut, yaitu:
1. Sederhana
2. Cepat
3. Dapat dengan alat yang minimal
4. Mampu menjelaskan golongan senyawa yang diidentifikasi
5. Bersifat semikualitatif yaitu memiliki batasan kepekaaan untuk senyawa yang dianalisis
6. Dapat memberikan keterangan ada atau tidaknya senyawa dari golongan yang dianalisis
(Robinson, 1996).
V. Alat dan Bahan
5.1 Alat
Tabung reaksi 20 bh
Erlenmeyer 250 ml
Plat tetes
Gelas kimia 200ml
Pipet tetes
Lumping
Corong gelas
Gelas ukur
5.2 Bahan
Pereaksi Dragendorf
Kloroform
NaOH padatan
Pereaksi Meyer
Etanol
Brusin
Pereaksi Wagner
Methanol
Iodine
Shinoda
Heksan
KI
Pandan
Kayu manis
Belimbing wuluh
Serai
Jeruk purut
VI. Prosedur Kerja
Adapun prosedur kerja pada percobaan ini adalah sebagai berikut :
a) Pemeriksaan Alkaloida
1. Dihaluskan simplisia tumbuhan sebanyak 2-4 gr pada lumpang dengan menambahkan sedikit kloroform dan pasir bersih (silica).
2. Bahan tumbuhan yang sudah halus dibasahi dengan 10ml kloroform, lalu gerus lagi dan ditambahkan 10 ml kloroform amoniak 1/20 N dan gerus lagi.
3. Saring bahan yang telah digerus tadi kedalam tabung reaksi, tambahkan 10 tetes larutan asam sulfat 2N, lalu dikocok.
4. Dipisahkan dan didekantasikan lapisan asam kedalam tiga tabung reaksi kecil dan masing-masing tabung ditambahkan dengan satu tetes pereaksi Meyer, Wagner, dan Dragendorf.
b) Pemeriksaan Steroid dan Terpenoid
1. Dimasukkan simplisia tumbuhan 5 gr kering yang telah dirajang halus kedalam erlenmeyer 250 ml. Lalu tambahkan dengan 25 ml etanol dan diaduk-aduk.
2. Panaskan diatas penangas air selama 10 menit (jangan menggunakan api langsung), dan saring dalam keadaan panas.
3. Diuapkan filtrat pelarutnya dengan rotary evaporator atau dengan menggunakan penangas air sehingga diperoleh ekstrak pekat etanol.
4. Dititrasi ekstrak pekat etanol dengan sedikit eter dan beberapa tetes larutan eter ditempatkan dalam 2 lobang plat tetes dan biarkan kering.
5. Ditambahkan 2-3 tetes anhidrida asam asetat, diaduk dengan hati-hati.
6. Ditambahkan 1 tetes asam sulfat pekat dan amati perubahan warna yang terbentuk.
7. Periksalah reaksi dengan menambahkan asam sulfat pekat pada lobang plat tetes yang satu lagi, amati warna yang terjadi. Kalau terbentuk warna yang sama sangat boleh jadi contoh tumbuhan yang diperiksa tidak mengandung terpenoida tapi senyawa lain yang bereaksi dengan asam sulfat pekat.
c) Pemeriksaan Flavonoida
1. Diekstrasksi 0,5 gr simplisia tumbuhan yang telah dihaluskan dengan 10 ml etanol panas selama 5 menit dalam tabung reaksi.
2. Disaring hasil ekstrak dan filtratnya ditambahkan beberapa tetes HCl pekat, lalu ditambahkan lebih kurang 0,2 gr bubuk magnesium. Bila timbul warna merah tua, menandakan contoh mengandung flavonoid. Cara uji teknik shinoda (Mg+HCl).
3. Cara lain pengujian flavonoid, dengan menambahkan ekstrak etanol diatas dengan 2 tetes NaOH 10% . adanya flavonoid ditandai dengan perubahan warna kuning-orange merah.
d) Pemeriksaan Saponin
1. Dimasukkan lebih kurang 0,5 gr bahan tumbuhan kedalam tabung reaksi, lalu tambahkan 10 ml air panas dan biarkan menjadi dingin kemudian dikocok selama 10 detik.
2. Bila terbentuk busa yang stabil setinggi 1-10cm selama 10 menit tidak hilang saat penambahan 1 tetes asam klorida 2N pada perlakuan ini, berarti tes saponin adalah positif.
e) Pemeriksaan Kuinon
Dipotong-potong halus simplisia tumbuhan, kemudian diekstraksi dengan eter. Jika warna contoh yang diuji masuk kedalam pelarut eter boleh jadi zat warna yang ada adalah kuinon.
f) Pemeriksaan Kumarin
Ekstrak metanol atau ekstrak dari simplisia tumbuhan dapat dideteksi keberadaan kumarinnya dengan cara ekstrak etanol atau metanol dari contoh kromatografi lapis tipis, dengan menggunakan eluen etil asetat atau etil asetat : metanol (9:1) atau (8:2). Dibawah sinar ultraviolet gelombang panjang 360 nm kumarin biasanya akan berfloresensi biru dan kalau noda ini diberi uap ammonium akan terlihat noda yang berwarna kuning.
Permasalahan
1. Pada percobaan ini, diguunakan 3 pereaksi untuk pemeriksaan alkaloid. Bisakah kita hanya menggunakan satu pereaksi saja?
2. Apa peran asam sulfat dalam proses identifikasi Steroid dan Terpenoid?
3. Untuk menguji adanya kandungan alkaloid bisa menggunakan 3 pereaksi dan dengan indicator brusin. Manakah yang lebih efektif?
II. Hari/Tanggal : Rabu, 16 Oktober 2019
III. Tujuan : Adapun tujuan dari percobaan ini adalah
1. Dapat mengenal dan memahami teknik-teknik skrinning fitokimia bahan alam
2. Dapat mengetahui jenis-jenis pereaksi yang digunakan dalam skrinning fitokimia bahan kimia.
3. Dapat melakukan skrinning fitokimia bahan alam dari suatu simplisia tumbuhan.
IV. Landasan Teori
Tumbuhan memiliki kemampuan untuk menghasilkan suatu senyawa yang istimewa memalui kemampuannya dalam metabolism. Senyawa-senyawa yang dapat dihasilkan oleh tumbuhan dikelompokkan menjadi dua kelompok, yaitu:
1. Senyawa dari metabolism primer
Senyawa yang termasuk kelompok ini adalah senyawa-senyawa organic yang dapat digunakan untuk metabolism tumbuhan tersebut. Contohnya karbohidrat, lipid, protein, dan asam amino.
2. Senyawa dari metabolism sekunder
Senyawa yang termasuk kelompok senyawa ini adalah senyawa organic hasil sampingan dari metabolism. Senyawa-senyawa golongan ini biasanya memiliki banyhak manfaat untuk pengobatan. Contohnya seperti alkaloid, steroid, flavonoid, terpenoid, fenolik, kumarin, kuinon, tinnin, lignin, dan glikosida.
Senyawa-senyawa organic yang dihasilkan melalui metabolism sekunder ini sering disebut kimia bahan alam
(Tim Kimia Organik, 2019)
Senyawa-senyawa bahan alam hasil metabolism sekunder memiliki banyak sekali manfaat apabila dikonsumsi oleh makhluk hidup. banyak. Oleh sebab itu, banyak para ilmuwan terutama di bidang farmasi, mempelajari bagaimana mengisolasi senyawa bahan alam ini. Sebnyawa-senyawa ini dapat diidentifikasi dengan beberapa pereaksi, dimana senyawa-senyawa ini akan menghasilkan ciri-ciri tertentu apabila direaksikan dengan pereaksi tertentu pula (Kristianti, 2006).
Farnsworth (1996) menyatakan bahwa skrinning fitokimia merupakan proses pemeriksaan kandungan senyawa-senyawa aktif yang terdapat pada tumbuhan. Pemeriksaan senyawa –senyawa ini dilakukan dengan menanbahkan pereaksi-pereaksi yang sesuai.
Metode skrinning fitokimia ini merupakan suatu proses pemeriksaan kandungan senyawa-senyawa aktif yang terdapat pada tumbuhan. Pemeriksaan senyawa –senyawa ini dilakukan dengan menanbahkan pereaksi-pereaksi yang sesuai. Pad pereaksian ini akan menghasilkan perubahan warna. Dengan perubahan warna inilah kita dapat mengetahui ada tidaknya kandungan senyawa bahan alam (Fessenden, 1981).
Pemilihan metode skkrinning dilakukan harus memenuhi syarat berikut, yaitu:
1. Sederhana
2. Cepat
3. Dapat dengan alat yang minimal
4. Mampu menjelaskan golongan senyawa yang diidentifikasi
5. Bersifat semikualitatif yaitu memiliki batasan kepekaaan untuk senyawa yang dianalisis
6. Dapat memberikan keterangan ada atau tidaknya senyawa dari golongan yang dianalisis
(Robinson, 1996).
V. Alat dan Bahan
5.1 Alat
Tabung reaksi 20 bh
Erlenmeyer 250 ml
Plat tetes
Gelas kimia 200ml
Pipet tetes
Lumping
Corong gelas
Gelas ukur
5.2 Bahan
Pereaksi Dragendorf
Kloroform
NaOH padatan
Pereaksi Meyer
Etanol
Brusin
Pereaksi Wagner
Methanol
Iodine
Shinoda
Heksan
KI
Pandan
Kayu manis
Belimbing wuluh
Serai
Jeruk purut
VI. Prosedur Kerja
Adapun prosedur kerja pada percobaan ini adalah sebagai berikut :
a) Pemeriksaan Alkaloida
1. Dihaluskan simplisia tumbuhan sebanyak 2-4 gr pada lumpang dengan menambahkan sedikit kloroform dan pasir bersih (silica).
2. Bahan tumbuhan yang sudah halus dibasahi dengan 10ml kloroform, lalu gerus lagi dan ditambahkan 10 ml kloroform amoniak 1/20 N dan gerus lagi.
3. Saring bahan yang telah digerus tadi kedalam tabung reaksi, tambahkan 10 tetes larutan asam sulfat 2N, lalu dikocok.
4. Dipisahkan dan didekantasikan lapisan asam kedalam tiga tabung reaksi kecil dan masing-masing tabung ditambahkan dengan satu tetes pereaksi Meyer, Wagner, dan Dragendorf.
b) Pemeriksaan Steroid dan Terpenoid
1. Dimasukkan simplisia tumbuhan 5 gr kering yang telah dirajang halus kedalam erlenmeyer 250 ml. Lalu tambahkan dengan 25 ml etanol dan diaduk-aduk.
2. Panaskan diatas penangas air selama 10 menit (jangan menggunakan api langsung), dan saring dalam keadaan panas.
3. Diuapkan filtrat pelarutnya dengan rotary evaporator atau dengan menggunakan penangas air sehingga diperoleh ekstrak pekat etanol.
4. Dititrasi ekstrak pekat etanol dengan sedikit eter dan beberapa tetes larutan eter ditempatkan dalam 2 lobang plat tetes dan biarkan kering.
5. Ditambahkan 2-3 tetes anhidrida asam asetat, diaduk dengan hati-hati.
6. Ditambahkan 1 tetes asam sulfat pekat dan amati perubahan warna yang terbentuk.
7. Periksalah reaksi dengan menambahkan asam sulfat pekat pada lobang plat tetes yang satu lagi, amati warna yang terjadi. Kalau terbentuk warna yang sama sangat boleh jadi contoh tumbuhan yang diperiksa tidak mengandung terpenoida tapi senyawa lain yang bereaksi dengan asam sulfat pekat.
c) Pemeriksaan Flavonoida
1. Diekstrasksi 0,5 gr simplisia tumbuhan yang telah dihaluskan dengan 10 ml etanol panas selama 5 menit dalam tabung reaksi.
2. Disaring hasil ekstrak dan filtratnya ditambahkan beberapa tetes HCl pekat, lalu ditambahkan lebih kurang 0,2 gr bubuk magnesium. Bila timbul warna merah tua, menandakan contoh mengandung flavonoid. Cara uji teknik shinoda (Mg+HCl).
3. Cara lain pengujian flavonoid, dengan menambahkan ekstrak etanol diatas dengan 2 tetes NaOH 10% . adanya flavonoid ditandai dengan perubahan warna kuning-orange merah.
d) Pemeriksaan Saponin
1. Dimasukkan lebih kurang 0,5 gr bahan tumbuhan kedalam tabung reaksi, lalu tambahkan 10 ml air panas dan biarkan menjadi dingin kemudian dikocok selama 10 detik.
2. Bila terbentuk busa yang stabil setinggi 1-10cm selama 10 menit tidak hilang saat penambahan 1 tetes asam klorida 2N pada perlakuan ini, berarti tes saponin adalah positif.
e) Pemeriksaan Kuinon
Dipotong-potong halus simplisia tumbuhan, kemudian diekstraksi dengan eter. Jika warna contoh yang diuji masuk kedalam pelarut eter boleh jadi zat warna yang ada adalah kuinon.
f) Pemeriksaan Kumarin
Ekstrak metanol atau ekstrak dari simplisia tumbuhan dapat dideteksi keberadaan kumarinnya dengan cara ekstrak etanol atau metanol dari contoh kromatografi lapis tipis, dengan menggunakan eluen etil asetat atau etil asetat : metanol (9:1) atau (8:2). Dibawah sinar ultraviolet gelombang panjang 360 nm kumarin biasanya akan berfloresensi biru dan kalau noda ini diberi uap ammonium akan terlihat noda yang berwarna kuning.
Video terkait dengan percobaan :
Permasalahan
1. Pada percobaan ini, diguunakan 3 pereaksi untuk pemeriksaan alkaloid. Bisakah kita hanya menggunakan satu pereaksi saja?
2. Apa peran asam sulfat dalam proses identifikasi Steroid dan Terpenoid?
3. Untuk menguji adanya kandungan alkaloid bisa menggunakan 3 pereaksi dan dengan indicator brusin. Manakah yang lebih efektif?
Widya aria ningsih (RRA1C117001)
BalasHapus2.fungsi penambahan asam sulfat yaitu untuk membuktikan terjadinya pembentukan cincin kecoklatan pada pembatasan dua pelaruts serta terjadinya perubahan warna hijau sampai biru yg menunjukkan kalau mengandung steroid.
1. tidak bisa, karena setiap senyawa dapat di identifikasi dengan pereaksi yang berbeda-beda. kecuali untuk steroid dan terpenoid
BalasHapus3. Lebih efektif menggunakan 3 pereaksi jika ketiga pereaksi itu memang ada di lab kita. Setau saya indikator brusin tidak tersedia di lab kita.
BalasHapus