Jurnal Praktikum Kimia Organik II Percobaan 4 "Pembuatan Senyawa Organik Ester Metil Salisilat (Minyak Gandapura)"
I. Judul : Pembuatan Senyawa Organik Ester Metil Salisilat (Minyak Gandapura)
II. Hari/Tanggal : Rabu/ 02 Oktober 2019
III. Tujuan : Adapun tujuan dari percobaan kali ini adalah :
1. Dapat memahami cara pembuatan minyak gandapura secara sintetis
dari asam salisilat dan methanol.
2. Dapat mengetahui bahwa minyak gandapura merupakan ester
karboksilat.
3. Dapat menentukan sifat fisik dan kimia dari minyak gandapura.
4. Dapat mengetahi jenis reaksi sintesis pembuatan minyak gandapura.
IV. Landasan Teori
Minyak gandapura merupakan sejenis obat gosok yang dapat digunakan untuk menghilangkan rasa sakit local seperti nyeri otot yang efektif dan tidak mempunyai efek samping yang serius pada kulit. Pada pembuatan minyak gandapura ini terjadi proses esterifikasi yaitu reaksi antara asam karboksilat dengan alcohol yang menghasilkan ester dan juga air. Jika reaksi yang berlangsung pada suhu tinggi dengan memakai refluks atau pendingin balik dan katalisator seperti asam kuat, maka reaksi itu akan dipercepat dan juga kesetimbangan tentunya lebih mudah untuk dicapai (Asas Le Chathelier). Pada percobaan ini juga menggunakan bahan metil salisilat yaitu merupakan ester dari suatu asam karboksilat. Metil salisilat ini dapat diperoleh dengan cara mereaksikan asam salisilat dengan alkohol. Sebenarnya, metil salisilat ini awalnya diperoleh secara alami dengan cara mengisolasinya dari tumbuhan gandapura (Gauliheri Procumbens). Metil salisilat ini juga sering dikenal dengan minyak dari winter green (Tim Kimia Organik II, 2015).
Metil salisilat merupakan senyawa organic yang biasa dikenal dengan minyak gandapura dan nbanyak ditemukan dalam tanaman. Metil salisilat dap[at pula diproduksi melalui reaksi esterifikasi asam salisilat dengan alcohol. Produksi metil salisilat atau minyak gandapura melalui reaksi esterifikasi ini dibantu dengan katalis asam sulfat (Daniel, 2011).
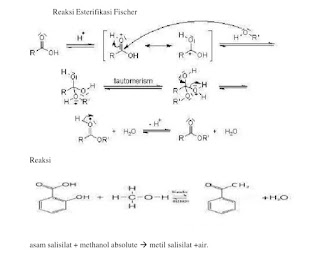
Ester asam karboksilat merupakan senyawa organic yang memiliki gugus –CO2R, dimana R dapat merupa alkil. Senyawa metil salisilat atau minyak gandapura ini dapat diproduksi langsung dengan mereaksikan asam karboksilat dengan alcohol. Reaksi antara asam karboksilat dan alcohol ini disebut reaksi esterifikasi. Berikut merupakan reaksi esterifikasi Fischer:
(Fessenden, 1981).
Selain asam sulfat, pada reaksi esterifikasi untuk pembuatan metil salisilat ini dapat pula digunakan katalis gas hydrogen klorida kering. Namun untuk reaksi yang menggunakan katalis gas hydrogen klorida kering ini cenderung terjadi pada ester-ester aromatic atau ester yang mengandung cincin benzena (firdaus, 2009).
V. Alat dan Bahan
5.1 Alat
- Labu dasar bulat 500ml - Labu destilasi 100ml
- Termometer - Pendingin (liebig)
- Corong Pisah - Pipa Bengkok
- Erlenmeyer 200ml
5.2 Bahan
- 28 gr Asam Salisilat - 81 ml Methanol
- Natrium Bikarbonat - 8 ml Asam Sulfat Pekat
- Magnesium Sulfat Anhidrat
VI. Prosedur Kerja
Adapun langkah kerja dari percobaan kali ini adalah:
1. Dalam labu dasar bulat 500ml, masukkan 28 gr asam salisilat, 81 methanol, dan 8ml asam sulfat pekat, lalu dikocok.
2. Lengkapi labu dengan pendingin air, lalu refluks selama 1,5 jam dan biarkan campuran menjadi dingin.
3. Rubah posisi pendingin tegak menjadi miring untuk mendestilasi sisa methanol dengan memanaskan diatas penangas air.
4. Jika methanol habis terdestilasi, biarkan campuran larutan tersebut dingin.
5. Campuran larutan dari labu dituangkan kedalam corong pisah, lalu dicampur dengan 250ml aquades.
6. Kocok kuat-kuat larutan tersebut hingga terbentuk dua lapisan zat cair.
7. Alirkan lapisan ester (lapisan bawah) kedalam erlenmeyer.
8. Tambahkan larutan jenuh dari NaHCO3 sampai bebas asam, lalu ditambahkan kembali dengan anhidrida magnesium sulfat untuk mengeringkan ester salisilat selama 30 menit.
9. Saring dan filtrat yang terbentuk ditampung kedalam labu destilasi, kemudian destilasi diatas penangas air.
10. Catat temperatur pada waktu destilat ditampung.
11. Bila temperatur masih jauh dibawah titik didih metil salisilat 115˚C, maka murnikan kembali pada metil salisilat yang ditampung dengan mendestilasi kembali.
Adapun video terkait dengan percobaan ini adalah:
https://www.youtube.com/watch?v=vvrfHS4DRoM&t=750s
Permasalahan :
1. Apakah penambahan natrium bikarbonat dan anhidrat magnesium sulfat memberikan pengaruh yang besar pada percobaan ini?
2. Apakah proses refluks yang dilakukan pada percobaan ini harus 1.5 jam? apabila etanol telah habis terdestilasi sebelum 1.5 jam kita harus tetap melaksanakan refluks?
3. Larutan NaHCO3 digunakan untuk membebaskan campuran dari asm. Bagaimanakah larutan yang telas terbebas dari asam? Bagaimana reaksi NaCO3 dapat menghilangkan asam?
II. Hari/Tanggal : Rabu/ 02 Oktober 2019
III. Tujuan : Adapun tujuan dari percobaan kali ini adalah :
1. Dapat memahami cara pembuatan minyak gandapura secara sintetis
dari asam salisilat dan methanol.
2. Dapat mengetahui bahwa minyak gandapura merupakan ester
karboksilat.
3. Dapat menentukan sifat fisik dan kimia dari minyak gandapura.
4. Dapat mengetahi jenis reaksi sintesis pembuatan minyak gandapura.
IV. Landasan Teori
Minyak gandapura merupakan sejenis obat gosok yang dapat digunakan untuk menghilangkan rasa sakit local seperti nyeri otot yang efektif dan tidak mempunyai efek samping yang serius pada kulit. Pada pembuatan minyak gandapura ini terjadi proses esterifikasi yaitu reaksi antara asam karboksilat dengan alcohol yang menghasilkan ester dan juga air. Jika reaksi yang berlangsung pada suhu tinggi dengan memakai refluks atau pendingin balik dan katalisator seperti asam kuat, maka reaksi itu akan dipercepat dan juga kesetimbangan tentunya lebih mudah untuk dicapai (Asas Le Chathelier). Pada percobaan ini juga menggunakan bahan metil salisilat yaitu merupakan ester dari suatu asam karboksilat. Metil salisilat ini dapat diperoleh dengan cara mereaksikan asam salisilat dengan alkohol. Sebenarnya, metil salisilat ini awalnya diperoleh secara alami dengan cara mengisolasinya dari tumbuhan gandapura (Gauliheri Procumbens). Metil salisilat ini juga sering dikenal dengan minyak dari winter green (Tim Kimia Organik II, 2015).
Metil salisilat merupakan senyawa organic yang biasa dikenal dengan minyak gandapura dan nbanyak ditemukan dalam tanaman. Metil salisilat dap[at pula diproduksi melalui reaksi esterifikasi asam salisilat dengan alcohol. Produksi metil salisilat atau minyak gandapura melalui reaksi esterifikasi ini dibantu dengan katalis asam sulfat (Daniel, 2011).
Ester asam karboksilat merupakan senyawa organic yang memiliki gugus –CO2R, dimana R dapat merupa alkil. Senyawa metil salisilat atau minyak gandapura ini dapat diproduksi langsung dengan mereaksikan asam karboksilat dengan alcohol. Reaksi antara asam karboksilat dan alcohol ini disebut reaksi esterifikasi. Berikut merupakan reaksi esterifikasi Fischer:
(Fessenden, 1981).
Selain asam sulfat, pada reaksi esterifikasi untuk pembuatan metil salisilat ini dapat pula digunakan katalis gas hydrogen klorida kering. Namun untuk reaksi yang menggunakan katalis gas hydrogen klorida kering ini cenderung terjadi pada ester-ester aromatic atau ester yang mengandung cincin benzena (firdaus, 2009).
V. Alat dan Bahan
5.1 Alat
- Labu dasar bulat 500ml - Labu destilasi 100ml
- Termometer - Pendingin (liebig)
- Corong Pisah - Pipa Bengkok
- Erlenmeyer 200ml
5.2 Bahan
- 28 gr Asam Salisilat - 81 ml Methanol
- Natrium Bikarbonat - 8 ml Asam Sulfat Pekat
- Magnesium Sulfat Anhidrat
VI. Prosedur Kerja
Adapun langkah kerja dari percobaan kali ini adalah:
1. Dalam labu dasar bulat 500ml, masukkan 28 gr asam salisilat, 81 methanol, dan 8ml asam sulfat pekat, lalu dikocok.
2. Lengkapi labu dengan pendingin air, lalu refluks selama 1,5 jam dan biarkan campuran menjadi dingin.
3. Rubah posisi pendingin tegak menjadi miring untuk mendestilasi sisa methanol dengan memanaskan diatas penangas air.
4. Jika methanol habis terdestilasi, biarkan campuran larutan tersebut dingin.
5. Campuran larutan dari labu dituangkan kedalam corong pisah, lalu dicampur dengan 250ml aquades.
6. Kocok kuat-kuat larutan tersebut hingga terbentuk dua lapisan zat cair.
7. Alirkan lapisan ester (lapisan bawah) kedalam erlenmeyer.
8. Tambahkan larutan jenuh dari NaHCO3 sampai bebas asam, lalu ditambahkan kembali dengan anhidrida magnesium sulfat untuk mengeringkan ester salisilat selama 30 menit.
9. Saring dan filtrat yang terbentuk ditampung kedalam labu destilasi, kemudian destilasi diatas penangas air.
10. Catat temperatur pada waktu destilat ditampung.
11. Bila temperatur masih jauh dibawah titik didih metil salisilat 115˚C, maka murnikan kembali pada metil salisilat yang ditampung dengan mendestilasi kembali.
Adapun video terkait dengan percobaan ini adalah:
https://www.youtube.com/watch?v=vvrfHS4DRoM&t=750s
Permasalahan :
1. Apakah penambahan natrium bikarbonat dan anhidrat magnesium sulfat memberikan pengaruh yang besar pada percobaan ini?
2. Apakah proses refluks yang dilakukan pada percobaan ini harus 1.5 jam? apabila etanol telah habis terdestilasi sebelum 1.5 jam kita harus tetap melaksanakan refluks?
3. Larutan NaHCO3 digunakan untuk membebaskan campuran dari asm. Bagaimanakah larutan yang telas terbebas dari asam? Bagaimana reaksi NaCO3 dapat menghilangkan asam?
1. Iya, karena natrium salisilat terbentuk dari hasil reaksi antara natrium bikarbonat dan salisilat dimana berfungsi untuk menarik sisa air yang terdapat pada sampel. Sedangkan magnesium sulfat anhidrat itu sendiri juga sangat berpengaruh karena berfungsi untuk mengeringkan ester salisilat. Terimakasih
BalasHapus2. Tidak. Karena, ketika etanol yang kita refluks telah habis namun tetap di refluks maka zat lain akan ikut terefluks ketika pemanasan terus di lakukan selama 1,5 jam, dan suhu pun naik. maka zat lain akan ikut terefluks, dan akan terjadi pencampuran antara etanol dan zat lain.
BalasHapus3. bereaksi dengan asam , melepaskan karbon dioksida (secara teknis, asam karbonat , tetapi cepat terurai menjadi CO 2 dan H 2 O):
BalasHapusCaCO 3 ( s ) + 2 H + ( aq ) → Ca 2+ ( aq ) + CO 2 ( g ) + H 2 O ( l )
melepaskan karbon dioksida saat pemanasan, yang disebut reaksi dekomposisi termal , atau kalsinasi (hingga di atas 840 ° C dalam kasus CaCO 3 ), untuk membentuk kalsium oksida , yang biasa disebut kapur api , dengan reaksi enthalpy 178 kJ / mol:
CaCO 3 → CaO ( s ) + CO 2 ( g )
Kalsium karbonat akan bereaksi dengan air yang jenuh dengan karbon dioksida untuk membentuk kalsium bikarbonat yang larut.
2. Seharusnya iya, tp jika mengingat waktu, apabila tidak mencukupi bisa kita lakukan dengan waktu yg lebih singkat. Tp mungkin itu jg akan mempengaruhi hasil walaupun tidak banyak
BalasHapusMentholnya digerus dulu tidak??
BalasHapus